INTRODUCCIÓN:
A continuación vas a ver toda la información consultada sobre los grupos: VII A, VI A, V A, IV A de la tabla periódica.
VIIA:
El grupo VIIA de la tabla periódica es también conocido como halógenos. El término halógeno procede del griego y significa formador de sales. Dicho término, surge por la propiedad que posee cada uno de los halógenos de formar, con el sodio, una sal similar a la sal común (cloruro de sodio).
Los halógenos son altamente reactivos, por lo que pueden ser dañinos para organismos biológicos en suficientes cantidades. Su alta reactividad se debe a la alta electronegatividad que sus átomos presentan por sus cargas nucleares altamente efectivas. Los halógenos tienen 7 electrones de valencia en su capa de energía externa por lo que al reaccionar con otro elemento satisfacen la regla del octeto. Fluoruro es el más reactivo de los elementos, ataca a materiales inertes como el vidrio y forma compuestos con los gases nobles inertes. Es un gas corrosivo y altamente tóxico.
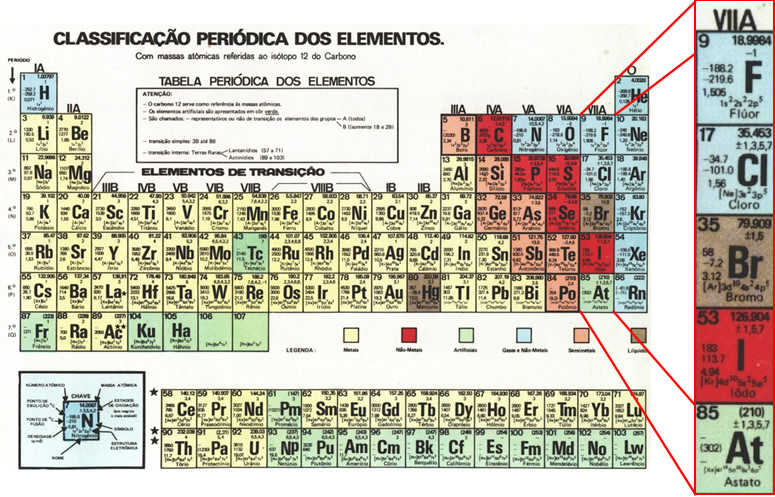
-Elementos que lo componen:
Los elementos que componen este grupo son:
- Flúor (F)
- Cloro (Cl)
- Bromo (Br)
- Iodo (I)
- Astato (At)
Estos son elementos muy reactivos, nunca se encuentran libres en la naturaleza. Tienen siete electrones de valencia y una fuerte tendencia a ganar un electrón.
A temperatura ambiente, se hallan en los tres estados de la materia: en estado sólido el iodo y ástato, en estado líquido: bromo y en estado gaseoso el flúor y cloro.
- Flúor(F): Es un gas de color amarillo claro, levemente más pesado que el aire, corrosivo y de olor fuerte e irritante.
- Cloro(Cl): Es un gas amarillo verdoso de olor irritante y fuerte.
- Bromo(Br):Es un líquido de color rojo oscuro, muchísimo más denso que el agua, que fácilmente se evapora originando un vapor rojizo venenoso.
- Iodo(I): Es un sólido cristalino de color negro y brillante, que sublima originando un vapor violeta bastante denso, venenoso y con un olor fuerte e irritante semejante al cloro.
- Astato(At): Es muy raro, debido a que es producto intermedio de unas series de desintegración radiactiva.
-Propiedades Físicas:
- Son elementos no metálicos.
- El carácter metálico aumenta según se desciende en el grupo, es decir, a medida que aumenta el número atómico, por lo tanto, el yodo posee brillo metálico.
- Los halógenos se presentan en moléculas di atómicas y sus átomos se mantienen unidos por enlace covalente simple y la fuerza de dicho enlace disminuye al descender en el grupo.
- Los puntos de fusión y ebullición aumentan al descender en el grupo.
-Propiedades Químicas:
- Los halógenos poseen 7 electrones en su capa más externa, lo que les proporciona un número de oxidación de -1, siendo considerablemente reactivos. Dicha reactividad disminuye según aumenta el número atómico.
- De igual manera, también exhiben los estados de oxidación +1, +3, +5, +7, con excepción del flúor, el cual es el elemento más reactivo y más electronegativo del grupo y de la tabla periódica.
- Se disuelven en agua y reaccionan parcialmente con ella, a excepción del flúor que la oxida.
- Reaccionan con el oxígeno produciendo óxidos inestables. Dicha reactividad disminuye a medida que se desciende en el grupo.
- Reaccionan con el hidrógeno para originar haluros de hidrógeno, los cuales se disuelven en agua, generando los ácidos hidrácidos. El ácido más fuerte es el yoduro de hidrógeno (HI).
- Reaccionan con algunos metales formando haluros metálicos, casi todos ellos iónicos.
VIA:
El grupo VIA es también llamado como anfígenos, calcógenos o la familia del oxígeno. El término anfígeno procede del griego y significa formador de ácidos y bases. Por su parte, el término calcógeno proviene del griego y significa formador de minerales.
Por encontrarse en el extremo derecho de la Tabla Periódica es fundamentalmente no-metálico; aunque, el carácter metálico aumenta al descender en el grupo .
Como en todos los grupos, el primer elemento, el oxígeno, presenta un comportamiento anómalo, ya que al no tener orbitales d en la capa de valencia, sólo puede formar dos enlaces covalentes simples o uno doble, mientras que los restantes elementos pueden formar 2, 4 y 6 enlaces covalentes.


-Elementos que los componen:
- Oxígeno (O)
- Azufre (S)
- Selenio (Se)
- Telurio (Te)
- Polonio (Po)
- El elemento sintético Livermorio (Lv).
Aunque todos ellos tienen seis electrones de valencia (última capa s2p4),1 sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta su número atómico.
El oxígeno y el azufre se utilizan abiertamente en la industria y el telurio y el selenio en la fabricación de semiconductores.
- Oxigeno (O): El oxígeno es indispensable para la respiración de los seres vivos. Industrialmente el oxígeno se usa para tratar aguas residuales, y como desinfectante y blanqueador cuando se encuentra formando el peróxido de hidrogeno (agua oxigenada).
- Azufre (S): Es un elemento químico fundamental y un componente principal de los aminoácidos cisteina y metionina y, por lo tanto, indispensable para la síntesis de proteínas presentes en todos los organismos vivos. Por tal razón, muchos agricultores que cultivan alimentos orgánicos emplean azufre como un pesticida y fungicida natural.
- Selenio (Se):Diferentes formas le permiten al selenio tener múltiples aplicaciones dependiendo del alótropo. Por ejemplo, el selenio gris conduce la electricidad, sin embargo su conductividad varía con la intensidad luminosa, es decir, es buen conductor en la luz que en la oscuridad. Por tal razón, se emplea en dispositivos fotoeléctricos, como las células solares, cámaras de rayos x, fotocopiadoras, medidores de luz, diodos LED de color azul y blanco, entre otros.
- Telurio (Te): El telurio aleado con otros elementos es utilizado en la fabricación de discos compactos regrabables. La capa del CD-RW que contiene la información está constituida por una aleación cristalina de plata, indio, antimonio y telurio.
También se alea con cobre y plomo para mejorar la tenacidad y dureza a la hora de elaborar rectificadores y dispositivos termoeléctricos.
- Polonio (Po):Los isótopos del polonio son una excelente fuente de radiación alfa pura. Aleado con berilio, es una fuente de neutrones.
- Livermorio (Lv): Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en la investigación científica.

-Propiedades Físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta del selenio al polonio.
- El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3) o como normalmente se le conoce, el ozono. El ozono es un gas de olor picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente azulado.
- El azufre es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre, que son cadenas Sn (n = 3-10), S2.
- El selenio es un metaloide que presenta, al igual que el azufre, varias formas alotrópicas. Primero el selenio rojo coloidal, el cual está compuesto por moléculas Se8. El selenio negro vítreo formado por anillos Sen con n muy grande y variable (forma amorfa) y por último el selenio gris cristalino de estructura hexagonal, la cual es la forma más común y análoga a la del azufre plástico. Este alótropo exhibe aspecto metálico, de hecho es un semimetal y es fotoconductor.
- El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
- El polonio, el cual es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
-Propiedades Químicas:
- No reaccionan con el agua.
- No reaccionan con las bases a excepción del azufre.
- Reaccionan con el ácido nítrico concentrado, excepto el oxígeno.
- Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve reducida desde el oxígeno al teluro.
- Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo.
- Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo.
- Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
-Propiedades atomicas:
La configuración electrónica de los átomos de los elementos del grupo VIA en la capa de valencia es: ns2 np2+1+1. El oxígeno, cabeza de grupo, presenta, igual que en el caso del flúor, unas características particulares que le diferencian del resto (Principio de singularidad). Posibles formas de actuación:
- El oxígeno es un gas diatómico. El azufre y el selenio forman moléculas octa-atómicas S8 y Se8
- El telurio y el polonio tienen estructuras tridimensionales.
- El oxígeno, azufre, selenio y telurio tienden a aceptar dos electrones formando compuestos iónicos. Estos elementos también pueden formar compuestos moleculares con otros no metales, en especial el oxígeno.
- El polonio es un elemento radioactivo, difícil de estudiar en el laboratorio.
VA:
El grupo VA es también llamado como la familia del nitrógeno o los nitrogenoideos.

-Elementos que lo componen:
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Y el elemento sintético moscovium (Mc).
Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
- Nitrógeno (N):El nitrógeno es un gas que forma el 78% del aire. Comercialmente, del nitrógeno gaseoso (N2) se produce amoniaco, que es un componente común de fertilizantes y limpiadores caseros.
N: 2 s² 2 p³
- Fósforo (P): El fósforo se conoce en tres estados alotrópicos: el fósforo blanco que es muy venenoso y ocasiona graves quemaduras; el fósforo rojo y el negro. Estos últimos que son mas estables, se usan para hacer fósforos de seguridad.
P: 3 s² 3 p³
Las sales de nitrógeno y fósforo son indispensables para la fertilidad de la tierra.
- Arsénico (As): El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.
As: 4 s² 4 p³
- Antimonio (Sb): El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.
Sb: 5 s² 5 p³
- Bismuto (Bi): Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad.
Bi: 6 s² 6 p³
- Moscovium (Mc): Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades y conocerse muy poco sobre ellos, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.

-Propiedades Físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
- El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro.
- El fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.
- Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
- El arsénico gris metálico: es la forma más estable de las tres y es un buen conductor del calor pero bastante malo conductor de electricidad.
- El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
- El arsénico negro: Presenta propiedades intermedias entre las formas anteriores.
- El antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
- Antimonio puro gris plateado
- Antimonio blanco azulado: Es su forma más estable y metálica
- Antimonio negro: Inestable y no metálico
- Antimonio amarillo: Inestable y no metálico
- El elemento metálico de este grupo es el bismuto, el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio.
- Las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
-Propiedades Químicas:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
IV A:
El grupo IV A de la tabla periódica es también llamado como la familia del carbono o los carbonoideos.
La posición central de este grupo hace que su comportamiento sea un poco especial, sobre todo el de su primer elemento carbono, que, tiene la propiedad de unirse consigo mismo, formando cadenas y dando lugar así a una infinidad de compuestos que constituyen la llamada Química Orgánica.
El carácter metálico aumenta considerablemente conforme se desciende en el grupo, siendo el carbono un no-metal, el silicio y el germanio semimetales y el estaño, el plomo y el ununquadio típicos metales.

-Elementos que lo componen:
La posición central de este grupo hace que su comportamiento sea un poco especial, sobre todo el de su primer elemento carbono, que, tiene la propiedad de unirse consigo mismo, formando cadenas y dando lugar así a una infinidad de compuestos que constituyen la llamada Química Orgánica.
El carácter metálico aumenta considerablemente conforme se desciende en el grupo, siendo el carbono un no-metal, el silicio y el germanio semimetales y el estaño, el plomo y el ununquadio típicos metales.

-Elementos que lo componen:
- Carbono (C)
- Silicio (Si)
- Germanio (Ge)
- Estaño (Sn)
- Plomo (Pb)
- Flerovio (Fl)
Estos elementos componen más del 28% en masa de la corteza, siendo el silicio el más abundante, luego seguido del carbono. El germanio es el elemento menos abundante.
El silicio es el elemento principal de toda la estructura inorgánica y el carbono es el responsable de la vida orgánica de la superficie terrestre.
Los elementos metálicos de este grupo están clasificados en la tabla periódica como “otros metales” junto a los grupos 13 y 15. Poseen cuatro electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np2 (2 electrones s y 2 electrones p), exhibiendo los siguientes estados de oxidación: +4, +2 y -4: los compuestos con +4 y la mayoría de los de número de oxidación +2 son covalentes. El único ion -4 es el carburo.
- Carbono (C): El carbono presenta dos formas alotrópicas el carbono amorfo que es el grafito y el carbono cristalino que es el diamante. Ambos presentan usos bastantes importantes.
El carbono presenta múltiples aplicaciones siendo la más importante como
componente de hidrocarburos, principalmente los combustibles fósiles, es decir, petróleo y gas natural.
- Silicio (Si): El silicio es un semimetal y por lo tanto un semiconductor. Este elemento puede controlar el flujo eléctrico mediante el uso de partes de silicio; lo que lo hace indispensable en la industria eléctrica. Se utiliza en los ordenadores, radios, células solares, pantallas LCD y otros aparatos semiconductores.
De los compuestos importantes del silicio está el óxido de silicio (IV) o dióxido de silicio (SiO2) o como se le conoce también sílice.
- Germanio (Ge):El germanio al igual que el silicio es un semiconductor ampliamente utilizado en la industria electrónica.
También se emplea en aleaciones con galio y arsénico para elaborar transistores y todo tipo de aparatos tecnológicos.
Los cristales de germanio al mezclarse con elementos como fosforo, arsénico, antimonio, boro, aluminio y galio se comportan como rectificadores y por lo tanto es empleado desde la segunda guerra mundial como detectores para ultra alta frecuencia (UHF) en señales de radar y radio. Estos cristales también son utilizados como transistores y diodos.
- Estaño (Sn): El estaño es usado abundantemente en aleaciones con otros elementos como por ejemplo, con el cobre para obtener bronce, con el plomo en la soldadura, con el titanio para la industria aeroespacial. Por su parte, la aleación estaño-plomo-antimonio se usa para producir el metal de imprenta. Aleado con el niobio es usado en semiconductores y en el galvanizado de hilos conductores.
- Plomo (Pb): El plomo posee una gran cantidad de aplicaciones siendo la más destacada en la elaboración de baterías.
También se emplea en aleaciones, como por ejemplo con estaño para usarse en soldadura, revestimiento y utensilios de radiaciones. Aleado con arsénico para la insonorización de edificaciones, elaboración de perdigones, entre otros.
- Flerovio (Fl):Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.

-Propiedades Físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
- Por ejemplo, el primer elemento del grupo, el carbono es un no metal duro y sólido a temperatura ambiente. Este elemento puede encontrarse en la naturaleza en forma de carbono amorfo (grafito) y en forma de diamante. Ambas formas alotrópicas poseen coloraciones distintas, siendo el grafito de color negro y el diamante incoloro.
- Los elementos silicio y germanio, son los metaloides del grupo, y presentan una dureza intermedia. El silicio posee propiedades intermedias entre el carbono y el germanio. Su forma cristalina es bastante dura y muestra un brillo metálico de color grisáceo.
- El metaloide germanio es de color blanco grisáceo lustroso, quebradizo y conserva el brillo a temperaturas normales. Este elemento exhibe la misma estructura cristalina que el diamante.
- Los metales de este grupo son el estaño y el plomo. El estaño es de color plateado y maleable. Por su parte, el plomo es un metal pesado que rara vez se encuentra en estado elemental. Es de color plateado con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, inelástico y se funde con facilidad.
- Los puntos de fusión y ebullición son menores a medida de que se desciende en el grupo. Esto debido a que se pierde la fuerza de enlace entre los átomos.
-Propiedades Químicas:
- No reaccionan con el agua.
- El germanio, estaño y plomo son atacados por los ácidos.
- Son atacados por disoluciones alcalinas desprendiendo hidrógeno, a excepción del elemento carbono.
- Reaccionan con el oxígeno formando óxidos. Siendo los óxidos de carbono y silicio ácidos, el de estaño anfótero (es decir, que reacciona con ácidos y bases calientes) y lo mismo sucede con el plomo.
- Al formar hidruros presentan la habilidad de formar concatenación. La concatenación es la propiedad que poseen algunos elementos de unirse con otro átomo del mismo elemento para formar cadenas ya sea lineales ramificadas o cíclicas. Esta predisposición disminuye al descender en el grupo. La concatenación se le atribuye al elemento carbono, aunque también es un fenómeno suscitado en el silicio. Este fenómeno es la raíz de la química orgánica.
Gracias..

No hay comentarios:
Publicar un comentario